Química Orgánica
1) Definición
a) La química orgánica es la química del carbono y de sus compuestos. (orgánicos)
http://www.quimicaorganica.net/
b) La química orgánica define la vida.
http://www.visionlearning.com/library/modulo_espanol.php?mid=60&l=s&c3=
1.1) Importancia
Todos los seres vivos estamos formados por moléculas orgánicas (proteínas, ácidos nucleicos, azúcares y grasas.) Todos ellos están compuestos por una base principal la cual es el carbono. Los productos orgánicos están en nuestra vida en diferentes aspectos:
Ejemplo:
La ropa que vestimos
Los jabones
Champús
Desodorantes
Medicinas
Perfumes
Utensilios de cocina
La comida, etc.
El progreso de
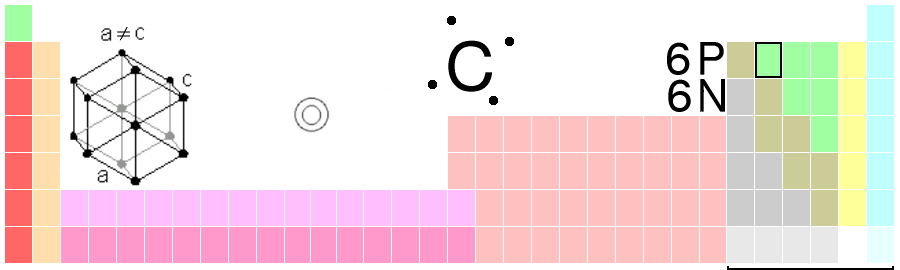
2) Estudio del átomo de carbono
Átomo de carbono (peso atómico = 12)
http://omega.ilce.edu.mx:3000/sites/ciencia/volumen1/ciencia2/51/htm/sec_5.html
2.1) Propiedades físicas
PROPIEDADES DEL ATOMO DEL CARBONO:
PROPIEDADES FISICAS:
El carbono existe en dos formas Alotrópicas : el grafito y el
diamante (estado puro).Ambos son cristalinos y los atomos estan enlazados fuertemente covalentes.
* El grafito es blando de color gris, punto de fusión elevado, bu-
en conductor de la electricidad y posee brillo metálico.
Debido a que la unión entre los diversos planos es débil, el gra- fito es una masa blanda lo que permite a las capas adyacentes deslizarse una sobre otra ello hace que el grafito es un buen lubricante.
El punto de fusión elevado se explica por el fuerte enlace existente entre los átomos del mismo plano lo que motiva que se precise elevada energía para desordenarlos. La conductividad eléctrica y brillo metálico se explican por el cuarto electrón semisuelto que puede saltar de un átomo a otro .
Se utiliza como electrodos inertes en pilas o celdas galvánicas.
* El diamante presenta diversas variedades, conocido por su dureza(10 en la escala de Mohs), y punto de fusión elevado : 3
http://html.rincondelvago.com/quimica-organica_2.html
2.2) Propiedades químicas (Descripción y esquemas)
Carbono | |
Número atómico | 6 |
Valencia | 2,+4,-4 |
Estado de oxidación | +4 |
Electronegatividad | 2,5 |
Radio covalente (Å) | 0,77 |
Radio iónico (Å) | 0,15 |
Radio atómico (Å) | 0,914 |
Configuración electrónica | 1s22s22p2 |
Primer potencial de ionización (eV) | 11,34 |
Masa atómica (g/mol) | 12,01115 |
Densidad (g/ml) | 2,26 |
Punto de ebullición (ºC) | 4830 |
Punto de fusión (ºC) | 3727 |
Descubridor | Los antiguos |
3) Funciones químicas
3.1) Definición
Se llama función Química al conjunto de propiedades comunes a una serie de compuestos análogos. Se conocen funciones en las dos químicas, mineral y orgánica; así son funciones de la química mineral la función anhídrido, función óxido, función ácido, función base y función sal.
3.2) Clasificación de las funciones químicas (considerando criterios)
Las funciones fundamentales son: la función alcohol, función aldehído, función cetona y función ácido.
Las funciones especiales son: la función éter, la función éster, función sal orgánica, función amina y amida y funciones nitrilo y cianuro.
http://html.rincondelvago.com/funcion-quimica.html
Cadena Saturada
Enlace simples
2 Higrógenos

No hay comentarios:
Publicar un comentario